
細胞是生物體基本的結構和功能單位,也是生命活動的基本單位。細胞模型已經成為藥物篩選和疾病研究最常用、也最基礎的生物平台。以細胞健康測定為例,以螢光標定後,可結合如微孔盤測讀,顯微影像或流氏系統進行定量分析。
螢光法是一種染色標定的策略,利用分子團可吸收特定波長的激發光(Excitation),短暫維持後逸散出發射光(Emission)的特性(圖1&圖2)。配合光學儀器的濾片篩選(圖3),將受標定的目標顯示出來。因為未被標定的背景及物體無法發光,可以大幅提昇觀測的靈敏度及動態範圍,特別適合用來觀測細胞,甚至次細胞層級的細微構造及變化。

細胞活力 從不同的切入點量測細胞健康/活力狀態,可以提供研究者更有效的資訊去評估諸如候選藥物反應,作用途徑的活化/抑制因子,報導基因等。這裡使用Calcium AM染劑為例,它是一種活細胞用的螢光細胞染劑,有絕佳的細胞膜穿透力。染劑進入細胞後,會被酯酶水解為Calcein,發出強綠色螢光。Calcein AM的另一優勢是的細胞毒性極低,非常適合於長時間活細胞實驗。 應用上也會搭配Ethidium homodimer(如EthD-III)等同時檢測細胞死亡事件。EthD-III本身幾無螢光,也不能通透細胞膜,但一旦細胞膜完整性破壞,EthD-III就可滲入並和核酸相結合,發出明亮的紅色螢光。Calcein AM與EthD-III同時使用,可以更靈敏的反應細胞群體的活力狀態,不受起始細胞密度誤差的影響,適用于高通量藥物毒性和細胞增殖分析。
【範例】以SpectraMax® iD3檢測細胞活力狀態
以SpectraMax iD3進行觀測及記錄,並以SoftMax Pro內建的EarlyTox範本進行後續分析。
【實驗材料及方法】
這裡推薦採用Molecular Devices提供的免洗式EarlyTox系列試劑盒,包括
· EarlyTox Live Cell Assay kit
(P/N R8342標準包或P/N R8343重量包)
· EarlyTox Glutathione Assay Kit
(P/N R8344標準包或P/N R8345重量包)
· EarlyTox Caspase-3/7 R110 Assay Kit
(P/N R8346標準包或P/N R8347重量包)
【主要步驟】(圖4):
HeLa細胞調整為20,000 cell/100uL的濃度,平舖於黑色透明底微孔盤(96 或 384 孔)。 以37°C/5% CO2條件過夜培養。細胞凋亡以10~40nM的staurosporine誘導,處理24小時。 加入2x working solution,室溫或 37°C下培養1小時。 按照推薦的參數進行檢測和分析。此步可以對比頂部讀取和底部讀取獲得最佳的設定,同時推薦孔掃描模式(well scan)提升資料的品質和一致性。
【範例】以 ImageXpress® Pico檢測細胞活力
【實驗材料】
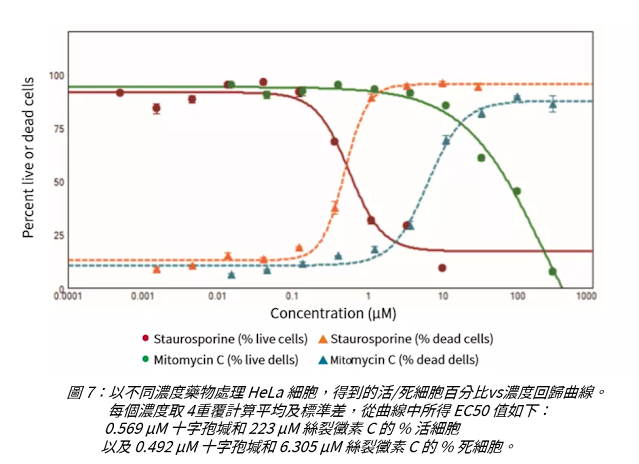
EarlyTox Live/Dead Assay Kit; HeLa細胞 (ATCC P/N CCL-2); Stauroporine (Sigma P/N S5921); Mitomycin C (Sigma P/N M4287); 384-孔黑色,透明底微孔盤 (Corning Falcon P/N 62406-490); ImageXpress Pico自動細胞影像系統和 CellReporterXpress軟體
【實驗方法】
HeLa細胞以5,000顆/孔密度,接種於384孔黑色透明底微孔盤中,過夜培養。 十字孢堿(staurosporine)和絲裂黴素C(Mitomycin C)處理細胞24小時,做4個平行,按1:3梯度稀釋,起始最高濃度為10μM星孢菌素和300μM絲裂黴素C Live/Dead檢測試劑結合Hoechst 33342細胞核染劑,對細胞進行染色 在 ImageXpress Pico系統上用10x Plan Fluor 物鏡進行成像:Calcein AM-FITC通道;EthD-III-Texas Red通道;Hoechst-DAPI通道
|
細胞凋亡 細胞凋亡是指為維持體內環境穩定,由基因控制的細胞自主、有序的死亡。與細胞壞死最大的不同是,它是主動而非被動的過程,涉及一系列基因的啟動、表達以及調控等的作用。 Caspase (cysteinyl aspartate specific proteinase,天冬氨酸蛋白水解酶)是一群細胞質中具有類似結構的蛋白酶,也是直接導致凋亡的蛋白酶系統,在誘導凋亡的過程中擔任重要角色。特別是細胞凋亡執行者caspase-3/6/7。
EarlyTox Caspase-3/7 NucView 488 檢測試劑盒
NucView 488 Caspase-3基質可用於檢測完整細胞中的Caspase-3/7活性,且不干擾Caspase活性。它是由一種可與Caspase-3/7 DEVD識別序列結合的螢光核酸染料組成。在細胞外不會發出螢光,但進入細胞質後,Caspase-3/7酶會將基質裂解,釋放出的核酸染料將染上細胞核,染劑會在在500nm激發光照射下發出明亮的綠螢光。
【範例】以SpectraMax i3x檢測細胞淍亡
使用 SpectraMax i3x 評估GM-CSF(粒細胞-巨噬細胞集落刺激因子) 和TNF-α(腫瘤壞死因子)誘導的細胞凋亡。
【實驗材料】
- U937 細胞(ATCC Cat.# CRL-1593.2)
- 人類 TNFα (Peprotech Cat# 300-01)
- 人類 GM-CSF(Peprotech Cat# 300-03)
- EarlyTox Caspase-3/7 NucView 488檢測試劑盒(Cat.#R8348)
- 96孔黑色透明底,TC-處理的微孔盤(Corning cat. #3904)
【實驗方法】
- U937細胞培養在RPMI1640培養基中,添加10%FBS和青黴素/鏈黴素。
- 實驗當天,細胞以每孔100,000細胞/80µL濃度接種。
- 每孔加入20µL的5X濃度細胞因子(最終濃度為1X,總體積為100µL)
- 在37°C、5% CO2下孵育處理24或48小時。
- 將10µM2X的NucView488基質工作液混合於PBS中,100µL基質工作液加入含有100 µL細胞和培養基的孔中形成終濃度為5µM基質,細胞在室溫下避光培養1小時。
- 上機,使用SpectraMax i3x進行讀盤。
結果顯示,單獨加入TNFα的組別,24小時/48小時不同處理時間上,皆有較明顯的劑量反應。相對單獨加入GM-CSF組別則沒有誘導細胞凋亡效果。但是當TNFα和GM-CSF混合則出現明顯的協同作用。有文獻指出GM-CSF相對於TNFα需要更長作用時間(>72小時)才能透過caspase-3途徑誘導U937細胞凋亡,本次試驗結果亦顯示,處理24小時的組別中,兩種細胞因子彼此有抵銷或干擾,但處理48小時後,兩者則明顯有協同作用,低濃度(5ng/mL)即能有效誘導細胞淍亡。
【範例】以 ImageXpress® Pico 系統分析細胞凋亡
【實驗材料】
- HeLa細胞(ATCC P/N CCL-2)
- HeLa培養基 :
DMEM: CellGro, with L-glutmaine(Corning);
10% FBS(BenchMark™;Gemini P/N 100-106)
- 1% penicillin/streptomycin
- Staurosporine(Sigma P/N S5921)
- Mitomycin C(Sigma P/N M4287)
- Camptothecin(Sigma P/N C9911)
- EarlyTox Caspase-3/7 NucView488 Assay Kit(Molecular Devices P/N R8348)
- 96孔黑色透明底微孔盤(Greiner P/N 655090)
- ImageXpress® Pico系統,進行全自動顯微影像擷取
- CellReporterXpress軟體,進行影像處理及量化分析
【實驗方法】
- 將HeLa細胞株培養在Greiner 96孔黑色透明底微孔盤中,種植5,000細胞/孔的濃度,以5% CO2/37°C條件下培養過夜。
- 次日,處理不同濃度的藥物18小時,誘導細胞凋亡。
- 十字孢堿(Staurosporine):最高10μM
- 絲裂黴素C (Mitomycin C):最高200μM
- 喜樹堿(Camptothecin):最高100μM
- 以EarlyTox Caspase-3/7試劑組進行細胞染色
- 加入5μM NucView 488和3μM Ethidium Homodimer III,
- 培養30分鐘最後加入6μM Hoechst 33342染核,培養15分鐘。
- 以ImageXpress®Pico系統進行影像擷取
- 將製備完成的樣品盤放入樣品艙
- 設定拍照條件為:10x物鏡,每孔一張,
- 濾片組選擇DAPI=20ms,FITC=500ms和 TexasRed=50ms),
- PS:曝光時間依實際樣品狀態調整。
- 以CellReporterXpress軟體進行量化分析,得到凋亡細胞數量和百分比(綠vs藍)及死細胞數量/百分比(紅vs藍)。根據實驗結果繪制細胞凋亡、細胞死亡的濃度效應曲線,並計算EC50值。
|
螢光細胞檢測是目前最廣泛使用的技術,常用設備包括的微孔盤測讀儀、流式細胞儀、螢光顯微鏡、共軛焦顯微鏡、高內涵影像系統(HCS)等。本文介紹以EarlyTox試劑組為例,示範幾種常見的監測、觀察細胞健康狀態的方法,透過系統本身簡潔的操作及分析設定,協助使用者快速有效地取得量化資料,加速實驗進程。
除本文介紹範例外,如細胞核標記染料5-乙炔基-2’-去氧尿嘧啶核苷(Edu),也常用於測量細胞增殖,或測定細胞狀態的指標。另外,在如SpectraMax i系列的多功能微孔盤測讀儀上,除了螢光還可組合光吸收、冷光等方法學,供使用者針對不同需求及條件,進行細胞活力、毒性及凋亡的檢測,提供最大的應用彈性。



















留言
張貼留言